Recentemente, il mondo ha dovuto affrontare una devastante infezione da coronavirus pandemica globale, con oltre 45 milioni di infetti in tutto il mondo e oltre 300.000 morti al 15 maggio 2020, correlata a un nuovo coronavirus (2019-nCoV), caratterizzato da una morfologia sferica e identificato attraverso il sequenziamento di nuova generazione. La sequenza genetica di SARS-CoV-2 mostra più dell'80% di identità con SARS-CoV e il 50% con MERS-CoV . Da notare, SARS-CoV-2 possiede una maggiore trasmissibilità da uomo a uomo e una minore patogenicità rispetto a SARS-CoV.
Il Coronavirus appartiene alla famiglia dei Coronaviridae , sottofamiglia Coronavirinae , ordine Nidovirales e questa sottofamiglia comprende quattro generi: Alphacoronavirus , Betacoronavirus, Gammacoronavirus e Deltacoronavirus.
Il coronavirus possiede un genoma di RNA a singolo filamento, senso positivo, di lunghezza compresa tra 26 e 32 kilobasi. Il primo frame di lettura aperto rappresenta la maggior parte del genoma virale e codifica 16 proteine non strutturali, mentre gli altri frame di lettura aperti codificano proteine strutturali e accessorie. Il genoma virale residuo è responsabile dell'espressione di quattro proteine strutturali essenziali: spike glycoprotein, small envelope protein, matrix protein e nucleocapsid protein. In particolare, la glicoproteina spike (S) è composta da due subunità (S1 e S2). Gli omotrimeri delle proteine S sulla superficie virale sono responsabili del legame ai recettori dell'ospite (S1) e alla fusione della membrana (S2). Degno di nota, la subunità S1, come in altri beta-coronavirus, è composta da un nucleo e un sottodominio esterno e rappresenta solo un'identità amminoacidica del 40% con altri SARS-CoV. Tuttavia, in SARS-CoV-2, la subunità S2, che contiene un peptide di fusione, un dominio transmembrana e un dominio citoplasmatico, è altamente conservata. S1 interagisce direttamente con l'enzima 2 di conversione dell'angiotensina (ACE-2), il recettore funzionale espresso sulla superficie delle cellule ospiti polmonari, cardiache, renali, intestinali ed endoteliali. In particolare, le cellule del parenchima epiteliale alveolare di tipo II esprimono ACE-2. In particolare, le cellule epiteliali nasali, comprendenti due cluster di cellule caliciformi e un cluster di cellule ciliate, mostrano la più alta espressione tra tutte le cellule studiate nell'albero respiratorio. Poiché il virus può essere rilevato nei campioni del tratto respiratorio superiore, il nasofarinx può essere coinvolto come sito di replicazione. Inoltre, SARS-CoV-2 è anche in grado di infettare i linfociti T, nonostante i loro livelli di espressione di ACE-2 molto bassi, portando i ricercatori a ipotizzare la presenza di un recettore alternativo che consente l'ingresso virale in queste cellule. Inoltre, studi hanno dimostrato che la serina proteasi TMPRSS2 può innescare la proteina S, consentendo così la scissione della proteina spike e regolando l'intero meccanismo di ingresso virale. Possono essere coinvolte anche altre proteasi. La serina proteasi TMPRSS2 e la catepsina B / L, espresse dalle ghiandole salivari, dai polmoni, dall'intestino tenue, dal fegato, dai reni e dalle cellule endoteliali del cuore, potrebbero portare di conseguenza a vasculite sistemica, tromboembolia e coagulazione intravascolare disseminata. Ulteriori ipotetici bersagli potrebbero considerare altri componenti virali come ORF3b, non omologa a quella dei SARS-CoV, e una proteina secreta (codificata da ORF8), strutturalmente diversa da quella di SARS-CoV.
Sebbene il tratto respiratorio sia il principale portale di ingresso di SARS-CoV-2, può verificarsi anche coinvolgimento gastrointestinale associato a nausea, vomito e diarrea e persistenza di particelle virali. I primi studi hanno rilevato una bassa incidenza (1–3,5%) di manifestazioni gastrointestinali o epatiche, ma studi più recenti hanno riportato un più alto tasso di affezione (11,4–24,2%). Inoltre, nei soggetti affetti da SARS-CoV-2, le transaminasi possono variare da livelli lievi a livelli elevati, probabilmente correlati alla presenza di recettori ACE-2 sugli enterociti nell'ileo e nel colon, colangiociti ed epatociti. L'ACE-2 sembra mediare i processi infiammatori e, di conseguenza, l'insorgenza di diarrea. Poiché diversi studi hanno indicato una possibile trasmissione fecale-orale, SARS-CoV-2 RNA deve essere rilevato nelle feci dei pazienti affetti da Covid-19. Tuttavia, non è chiaro se la SARS-CoV-2 si replichi nell'intestino umano e contribuisca alla possibile trasmissione fecale-orale o se l'intestino sia un potenziale sito di replicazione della SARS-CoV-2, contribuendo così alla malattia locale e sistemica e in generale progressione della malattia. È noto che la disbiosi intestinale secondaria a infiammazione gastrointestinale può interferire con disturbi a distanza. Alla luce di questa visione, è stato ipotizzato un asse intestino-polmone, che agisce in modo bidirezionale: endotossine e metaboliti microbici sintetizzati dal microbiota intestinale possono influenzare il polmone attraverso la circolazione, mentre l'infiammazione polmonare può influenzare il microbiota intestinale. Pertanto, il microbiota intestinale potrebbe partecipare alla patogenesi della sindrome da distress respiratorio acuto e viceversa.
La maggior parte dei pazienti infetti da SARS-CoV-2 mostra sintomi da lievi a moderati, come anosmia improvvisa o ageusia, febbre, tosse anormale, mal di testa e affaticamento e diarrea e guarisce senza conseguenze. Tuttavia, circa il 15% sviluppa una polmonite grave e il 5% progredisce verso la sindrome da distress respiratorio acuto, shock settico e / o insufficienza multiorgano, associata ad alta mortalità.
Ferro e omeostasi infiammatoria
Tra i diversi fattori che influenzano le infezioni virali così come i relativi processi infiammatori, il ferro gioca un ruolo fondamentale, favorendo la progressione virale da un lato ed esacerbando i processi infiammatori dall'altro. In effetti, il ferro è un elemento cardine per tutte le cellule in quanto è fondamentale nella replicazione del DNA e nella produzione di energia sia nell'uomo che nei microrganismi. Quando il ferro è presente in eccesso, genera specie reattive dell'ossigeno (ROS), provocando la sua capacità di rilasciare elettroni all'ossigeno. La formazione di ROS danneggia le proteine, le membrane lipidiche e il DNA, causando danni ai tessuti e insufficienza d'organo. In condizioni di salute, il ferro disponibile libero è presente alla concentrazione di circa 10-18M, molto lontano da quello richiesto per la moltiplicazione microbica, la generazione di ROS e l'induzione del processo infiammatorio. In condizioni patologiche, la concentrazione di ferro libero è superiore a 10 −18 M, aumentando così la suscettibilità dell'ospite alle infezioni, ai ROS e all'induzione del processo infiammatorio. Il corretto equilibrio del ferro tra tessuti / secrezioni e sangue, definito come omeostasi del ferro, coinvolge diverse proteine del ferro, come la transferrina (Tf), la ferroportina (Fpn), la ferritina (Ftn), la lattoferrina (Lf) oltre che l'epcidina, un importante peptide sintetizzato dal fegato.
Durante le infezioni virali, l'omeostasi del ferro è perturbata, portando a disturbi del ferro che sono peggiorate dall'azione delle citochine proinfiammatorie, compresa l'interleuchina-6 (IL-6). Infatti, infezioni e processi infiammatori correlati, aumentando l'IL-6, inducono la sintesi di epcidina, che a sua volta blocca l'efflusso di ferro mediato da Fpn dalle cellule al sangue, riducendo così la concentrazione sierica di ferro e aumentando il sovraccarico di ferro nelle cellule reticoloendoteliali. Coerentemente, quando il livello sierico di IL-6 aumenta, la saturazione di ferro del Tf sierico, così come i livelli del recettore 1 (TfR1) e Fpn di Tf, diminuiscono. Pertanto, lo stato di ferro dell'ospite può alterare il corso dell'infezione e la sua risoluzione. Inoltre, le infezioni virali richiedono un metabolismo cellulare attivo e, quindi, una replicazione virale significativa richiede un'elevata disponibilità di ferro. Infatti, i disturbi dell'omeostasi del ferro tra cui Fpn, TfR1 e sintesi disregolata Ftn portano ad un sovraccarico di ferro intracellulare che facilita la moltiplicazione e la diffusione virale.
Pertanto, la disregolazione del ferro, indotta dall'infezione da SARS-CoV-2 e dai relativi processi infiammatori, potrebbe anche svolgere un ruolo cruciale nell'attivazione e nella progressione della compromissione degli organi.
Nei pazienti affetti da COVID-19, la maggior parte dei casi gravi ha dimostrato livelli sistemici massicci di biomarcatori correlati all'infezione e citochine infiammatorie, vale a dire IL-6 sierica, fattore di necrosi tumorale-α (TNFα) e nt.. L'eccessivo rilascio di citochine pro-infiammatorie, denominato `` tempesta di citochine '', si è evoluto come un importante sistema di sorveglianza che, una volta attivato, combatte l'infezione ed elimina gli agenti patogeni, ma può contribuire come causa principale contributiva di compromissione degli organi interni o dei sistemi come di recente ipotizzato per shock cardiovascolare, neurologico, settico o sequele cutanee o fattori di rischio correlati per prognosi sfavorevole.
Opzioni terapeutiche per Covid-19
Nessun farmaco o vaccino contro la SARS-CoV-2 è stato approvato a causa dell'assenza di evidenze derivanti da rigorosi studi clinici. Inoltre, sebbene alcuni trattamenti sembrino essere efficaci contro questo virus, esercitano diversi effetti negativi. Sono necessari farmaci sicuri ed efficaci per prevenire e curare la malattia da coronavirus 2019 (COVID-19).
Alla luce di queste considerazioni, accanto alla necessità di trovare specifici agenti antivirali sicuri o vaccini, sarebbe di fondamentale importanza aumentare le difese dell'ospite creando una barriera immunologica in grado di proteggere le prime vie respiratorie, considerata la principale via di accesso del virus al l'ospite o / e la mucosa intestinale. È un'osservazione degna di nota che un numero consistente di pazienti COVID-19 presenta diarrea e più spesso segni olfattivi e gustativi, anche con sintomi respiratori assenti o lievi e un normale esame otorinolaringoiatrico. Nei pazienti sintomatici e asintomatici, i tamponi nasali hanno prodotto una carica virale più elevata rispetto ai tamponi faringei, implicando l'epitelio nasale come portale per l'infezione e la trasmissione iniziali, mentre diversi ricercatori stanno testando la presenza del virus nelle feci.
Da notare, tra le diverse terapie, il plasma convalescente contenente anticorpi specifici contro SARS-CoV-2 può essere applicato come trattamento principale secondo le linee guida della National Health Commission della Repubblica Popolare Cinese (National Health Commission of the People's Republic of Cina, 2020. Avviso sulla stampa e la distribuzione del trattamento al plasma di convalescenza per la nuova polmonite da coronavirus (versione di prova 2). Tuttavia, la valutazione dell'efficacia del trattamento con plasma convalescente è ancora incerta e sono in corso studi clinici. Risultati promettenti sono stati ottenuti attraverso una terapia con anticorpi monoclonali, la principale classe di bioterapici per l'immunoterapia passiva, che già esercita un'interessante efficacia nel neutralizzare l'infezione da SARS-CoV e MERS-CoV. Tuttavia, la produzione su larga scala di anticorpi monoclonali è laboriosa, costosa e richiede tempo. La vaccinazione, basata su vaccini inattivati, subunità ricombinanti vaccini, vaccini a base di acido nucleico, vaccini vettore adenovirale e vaccini vettore virale influenzale ricombinante, è la strategia più efficiente per prevenire e controllare COVID-19, in particolare utilizzando come bersaglio la proteina S. Inoltre, è stato caratterizzato un set selezionato di epitopi di cellule B e cellule T derivati da SARS-CoV, che sarebbero fondamentali per la fase iniziale dello sviluppo del vaccino. Inoltre, per fornire risultati affidabili sull'efficacia del plasma convalescente e dei vaccini, sono stati proposti diversi farmaci per diminuire i processi iperinfiammatori durante COVID-19 e / o inibire l'ingresso e la fusione di SARS-CoV-2. In alcuni pazienti infetti da SARS-CoV-2, infatti, una disregolazione della risposta immunitaria porta ad una condizione iperinfiammatoria. Percentuali più elevate di cellule T positive al fattore stimolante le colonie granulociti-macrofagi (GM-CSF + ) e IL-6 + CD4 + sono state osservate su pazienti in unità di terapia intensiva (ICU) rispetto ai pazienti non ICU con COVID-19, indicando così che la tempesta di citochine è associata alla gravità della malattia. L'inibizione dell'eccessiva risposta infiammatoria da parte dei corticosteroidi può rappresentare una terapia aggiuntiva per COVID-19, anche se la loro efficacia contro questa malattia è ancora controversa. Le putative molecole antivirali sono focalizzate su componenti strutturali CoVs, rappresentate principalmente dalle due subunità spike sulla superficie virale, che regolano il legame ai recettori dell'ospite. Altri farmaci inibiscono l'ingresso di SARS-CoV-2. Come già riportato, la proteina S1 di SARS-CoV-2 media l'ingresso nelle cellule ospiti attraverso il legame con il recettore ACE-2. Tuttavia, è stato suggerito che l'ingresso di SARS-CoV-2 dipenda non solo da ACE-2 ma anche dalla serina proteasi della cellula ospite TMPRSS2. SARS-CoV-2 si lega al recettore ACE-2 attraverso la subunità S1 N-terminale, che viene successivamente scissa dalla serina proteasi transmembrana ospite 2 (TMPRSS2) per esporre la subunità S2 C-terminale che induce fusione virus-cellula. Un inibitore di TMPRSS2, il camostat mesilato, sembra ridurre significativamente l'infezione in vitro della linea cellulare polmonare con SARS-CoV-2, suggerendo così un presunto trattamento contro COVID-19. Inoltre, è stato anche suggerito che il trattamento con arbidolo sia in grado di inibire l'ingresso del virus. Per quanto riguarda il trattamento con la clorochina, un farmaco antimalarico tradizionale, la sua efficacia contro SARS-CoV-2 è stata dimostrata in vitro. Sono in corso sperimentazioni cliniche, anche se il meccanismo d'azione della clorochina è ancora sconosciuto, mentre è ben nota la sua tossicità. Infine, sono stati sviluppati diversi agenti antivirali contro proteasi virali, polimerasi, MTasi e proteine di ingresso. Nel complesso, l'immunoterapia con anticorpi IgG immunitari combinati con farmaci antivirali può essere un trattamento alternativo contro COVID-19 fino a quando non saranno disponibili opzioni più forti come i vaccini.
Pertanto, vi è un'urgente necessità di esplorare metodi alternativi per il trattamento, senza effetti avversi, delle condizioni clinicamente avanzate di COVID-19 al fine di ridurre l'infezione virale, la replicazione e la diffusione, nonché la mortalità e per mitigare i potenziali focolai futuri, prima del set. -up di vaccino. L'ipotesi di identificare molecole naturali, che, senza effetti collaterali, siano in grado di aumentare le difese locali dell'ospite o di inibire l'infezione virale oltre che di ripristinare i disturbi dell'omeostasi ferrica e infiammatoria, è estremamente allettante.
Lattoferrina
Recenti studi hanno dimostrato che i componenti delle secrezioni umane, appartenenti all'immunità innata, sono elementi chiave delle difese dell'ospite che agiscono come barriera fondamentale contro il danno virale. Molto recentemente è stato evidenziato un crescente interesse sul possibile ruolo preventivo e trattamento aggiuntivo della lattoferrina, una glicoproteina delle secrezioni umane che fa parte di un sistema difensivo aspecifico, noto per svolgere un ruolo importante contro le infezioni microbiche e virali e che esercitano effetti antinfiammatori su diverse superfici mucose e in grado di regolare il metabolismo del ferro.
La lattoferrina (Lf), appartenente alla famiglia Tf, è in grado di chelare reversibilmente due Fe (III) per molecola con elevata affinità (K d ~ 10 −20 M). È una glicoproteina cationica di ca. 690 residui di amminoacidi. A differenza di Tf, che rilascia ferro a valori di pH inferiori a 5,5, Lf lega il ferro ferrico fino a valori di pH di circa 3,0. La Lf umana (hLf), una molecola dell'immunità innata, è secreta costitutivamente dalle ghiandole esocrine e dai neutrofili nei siti di infezione e infiammazione (10 6 neutrofili rilasciano 15 µg di Lf). Anche se Lf è altamente conservato tra specie diverse, la più alta omologia di sequenza è stata riconosciuta tra lattoferrina umana e bovina (bLf) (circa 70%). BLf e hLf possiedono funzioni biologiche identiche e, pertanto, bLf è stato applicato in studi in vitro e in vivo, essendo generalmente riconosciuto come sicuro (GRAS) dalla Food and Drug Administration (FDA) e disponibile in grandi quantità. Le varie funzioni di Lf sono associate alla sua capacità di chelare due ioni ferrici e di legarsi alle superfici anioniche. Lf possiede una potente attività antinfiammatoria e immunomodulante.
L'attività antinfiammatoria di Lf dipende dalla sua capacità di entrare, attraverso l'endocitosi mediata dal recettore, all'interno delle cellule ospiti e di traslocare nel nucleo, regolando così l'espressione genica pro-infiammatoria. Lf, attraverso la sua attività antinfiammatoria e le proprietà immunomodulatorie, è anche in grado di down-regolare le citochine proinfiammatorie e di potenziare la risposta immunitaria adattativa. Inoltre, la capacità di Lf di contrastare e far regredire i disturbi del ferro, modulando la risposta immunitaria e sottoregolando le citochine pro-infiammatorie, come IL-6, è stata dimostrata sia in vitro che in vivo modelli, così come negli studi clinici. Da notare, è stato dimostrato che Lf agisce come un scavenger contro il sovraccarico di ferro e l'infiammazione nell'epitelio polmonare dei topi infettati da Pseudomonas aeruginosa e bLf è stato trovato per riequilibrare le proteine di manipolazione del ferro polmonare e ridurre il sovraccarico di ferro bronco-alveolare, uno dei principali attori nella progressione e esacerbazione dell'infezione. Diversi studi hanno descritto l'attività antivirale di Lf nei confronti di virus avvolti e nudi, correlati a diverse famiglie di virus, come Retroviridae (virus dell'immunodeficienza umana), Papillomaviridae ( papillomavirus umano ), Herpersviridae ( Citomegalovirus, Herpes simplex virus ), Caliciviridae ( calicivirus felino ), Flaviviridae ( virus dell'epatite C, virus dell'encefalite giapponese)Reoviridae ( rotavirus) , Adenoviridae ( adenovirus ), Pneumoviridae (virus respiratorio sinciziale), Paramixoviridae (virus parainfluenzale), Orthomixoviridae (virus influenzale A), Hepadnaviridae (B virus dell'epatite), Picornaviridae ( poliovirus, enterovirus 71, echovirus 6 ), Togaviridae ( Alphavirus) e Geminiviridae (virus dell'arricciatura delle foglie gialle del pomodoro). È stato scoperto che bLf ostacola l'ingresso virale nelle cellule ospiti attraverso il suo legame competitivo con i recettori della superficie cellulare, principalmente composti a carica negativa come i glicosaminoglicani (GAG). Inoltre, è stato riscontrato che Lf previene le infezioni virali legandosi alla molecola di adesione intercellulare specifica delle cellule dendritiche 3-grabbing non integrina (DC-SIGN) e recettori LDL. Nel complesso, l'effetto antivirale di Lf si manifesta nella fase iniziale dell'infezione, impedendo l'ingresso di particelle virali nelle cellule ospiti, bloccando i recettori cellulari e / o legandosi direttamente alle particelle virali. Inoltre, Lf è anche in grado di esercitare un'attività antivirale quando viene aggiunto nella fase post-infezione, come dimostrato nell'infezione da Rotavirus di Superti et al. e nell'infezione da HIV di Puddu et al. Se l'efficacia nella fase post-infezione ci induce a ipotizzare che questa glicoproteina sia efficace anche nell'interferire con la fase intracellulare dell'infezione virale.
Complessivamente, Lf esercita la sua attività antivirale contro la maggior parte dei virus testati legandosi all'eparina solfato, mentre contro pochi virus interagendo con i componenti superficiali delle particelle virali. In particolare, Lf si lega alle proteine E1 ed E2 dell'HCV, alla proteina F dell'RSV e alla proteina gp120 dell'HIV. Inoltre, Lf interagisce sia contro le particelle virali che contro le cellule ospiti quando esercita la sua attività antivirale contro l'Echovirus 6. La capacità di Lf di esercitare attività antivirale, legandosi a cellule ospiti o particelle virali o entrambe, rafforza l'idea che questa glicoproteina sia "un importante mattone nella parete mucosa, efficace contro gli attacchi virali". È importante ricordare che Lang e colleghi hanno studiato il ruolo di Lf nell'ingresso dello pseudovirus SARS nelle cellule Myc. I loro risultati rivelano che Lf è stato in grado di bloccare il legame della proteina spike alle cellule ospiti, indicando che Lf ha esercitato la sua funzione inibitoria nella fase di attacco virale. Tuttavia, Lf non ha bloccato l'ingresso del virus dall'interazione diretta della proteina spike con ACE-2, il recettore funzionale di SARS-CoV e SARS-CoV-2. L'attuale modello accettato suggerisce che Lf potrebbe bloccare l'ingresso virale interagendo con i proteoglicani di eparan solfato (HSPG), che mediano il trasporto di particelle di virus extracellulari dai siti di ancoraggio a bassa affinità all'ingresso specifico ad alta affinità come ACE-2. Presi insieme, questi risultati suggeriscono che Lf potrebbe svolgere un ruolo protettivo nella difesa dell'ospite contro l'infezione da SARS-CoV-2 attraverso il legame agli HSPG, bloccando così l'interazione precoce tra SARS-CoV-2 e cellule ospiti. Inoltre, la capacità di Lf di entrare nel nucleo può anche contrastare l'attivazione della tempesta di citochine, evitando così disturbi dell'omeostasi del ferro sistemica, polmonare o intestinale nonché esacerbazione della malattia. Recentemente, è stato dimostrato l'effetto di bLf, in un modello murino di fibrosi cistica (CF) di infezione polmonare cronica da Pseudomonas aeruginosa. Per indurre un'infezione polmonare acuta o cronica, i topi CF sono stati infettati intra-tracheali con MDR-RP73 multiresistente ai farmaci P. aeruginosa, libero o incorporato in perle di agar. I trattamenti con bLf aerosolizzato o soluzione salina sono stati eseguiti cinque minuti dopo l'infezione ed eseguiti quotidianamente per sei giorni. In topi CF infetti, bLf aerosol è stato trovato efficace nel ridurre in modo significativo sia il numero di P. aeruginosa polmonare che i leucociti infiltrati. Per la prima volta, i nostri risultati dimostrano che bLf ha anche ridotto l'eccesso di ferro polmonare, nei topi WT e CF. In particolare, l'espressione di Fpn e Ftn era notevolmente diminuita. Nel complesso, la multifunzionalità di bLf consente di bloccare l'infiammazione e lo squilibrio del ferro indotti da P. aeruginosa , diminuendo così la gravità dell'infezione correlata alla FC.
Un effetto recentemente studiato di Lf è quello di regolare l'attivazione del plasminogeno, che ancora aggiunge un valore di questa molecola nel controllo della cascata coagulativa promossa dal virus. LF può esercitare effetti regolatori negativi sulla migrazione cellulare attraverso l'inibizione dell'attivazione di Plg e attraverso la regolazione della fibrinolisi. Questa attività è stata confermata anche dall'evidenza di un peptide con la sequenza di amminoacidi derivata dalla lattoferrina che ha mostrato attività antitrombotica.
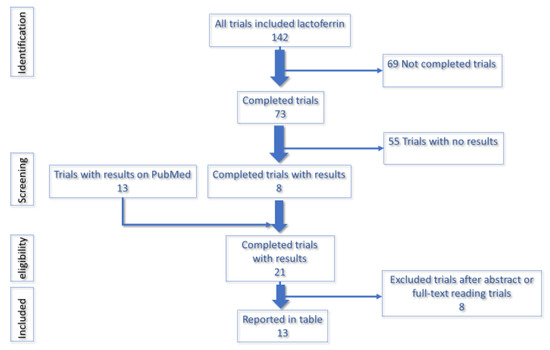
Più di 140 prove sono disponibili su trials.gov. Tra questi, è stato dimostrato un importante contributo della lattoferrina su anemia, infezioni batteriche e virali, sia comunitarie che nosocomiali, infiammazioni e prevenzione della sepsi. Questi studi hanno valutato la sicurezza, la tollerabilità, l'efficacia di Lf sia come integratore alimentare orale che come spray intranasale. Abbiamo eseguito una ricerca completa sul registro delle prove in corso del National Institutes of Health degli Stati Uniti, utilizzando la parola "lattoferrina". Il primo risultato includeva 142 prove. Quindi, abbiamo incluso solo "prove completate", che hanno dato 73. Tra queste 73 prove, abbiamo selezionato otto prove con risultati. Al fine di includere i risultati non disponibili sul registro delle prove in corso del National Institutes of Health degli Stati Uniti, abbiamo eseguito una ricerca incrociata su PubMed utilizzando il numero NTC. Questo ci ha permesso di includere altri 13 studi completati con risultati. Tra questi 21 studi, otto sono stati esclusi in quanto non pertinenti alla nostra revisione, analizzando altri farmaci. Complessivamente, nella tabella sono inclusi 13 studi completati con risultati. Tutti gli studi sull'uomo sono stati inclusi senza limitazioni di età, sesso, etnia o tipo di studio. Le prove senza risultati sono state escluse. Le analisi escludevano anche gli studi sugli animali.
Figura 1. Diagramma di flusso che riassume la strategia di ricerca per selezionare studi clinici sulla lattoferrina.
Nel loro insieme, tutte queste proprietà aprono la strada a considerare Lf come uno strumento promettente in grado di indirizzare aspetti multiformi della progressione virale e della patogenesi in COVID-19. Storicamente, il trattamento di molte malattie polmonari comportava la somministrazione sistemica del farmaco; tuttavia, questa modalità è stata generalmente sostituita dall'inalazione, che è più efficace, poiché indirizza il farmaco al sito della malattia, e più sicura, riducendo gli effetti collaterali. In sinergia, il successo di nuovi sistemi di somministrazione di farmaci dipende dallo sviluppo di formulazioni in grado di migliorare l'indice terapeutico di molecole biologicamente attive aumentandone la concentrazione in modo specifico nei siti o organi bersaglio desiderati. Per il miglior effetto terapeutico è necessario trovare la migliore formulazione farmacologica, sia per bloccare il virus nel microambiente extracellulare delle mucose, sia per stimolare l'immunità locale al fine di promuovere una migliore clearance della carica virale, considerando la necessità di agire a livello delle vie aeree superiori e inferiori. C'è la necessità di un formulato con caratteristiche chimico-fisiche differenti. Tra particolari metodi di somministrazione di farmaci usati per trattare le malattie polmonari, sono state proposte strutture simili a membrane composte da trigliceridi e fosfolipidi. La logica relativa all'uso di questo metodo di somministrazione dei farmaci si basa su una minore tossicità e una maggiore compatibilità biologica con l'epitelio polmonare. In alternativa, un'altra formulazione contenente liposomi potrebbe essere preparata con lipidi endogeni, che sono più facilmente adsorbiti dalle mucose respiratorie se somministrati per via intra-nasale. La loro composizione può essere regolata per modulare il rilascio del farmaco e potrebbero incapsulare composti sia idrofili che lipofili con elevato carico di farmaco. È noto che l'epitelio mucociliare non offriva una buona superficie per la somministrazione del farmaco. A questo livello, i liposomi potrebbero ridurre la clearance del farmaco, migliorandone l'assorbimento. L'RNA virale COVID-19 è stato rilevato nelle vie aeree superiori da pazienti sintomatici, con cariche virali più elevate osservate nei tamponi nasali rispetto a quelle ottenute dalla gola. Cariche virali simili sono state osservate in pazienti asintomatici, indicando che l'epitelio nasale è un importante portale per l'infezione iniziale e può servire da serbatoio chiave per la diffusione virale attraverso la mucosa respiratoria e un importante locus che media la trasmissione virale. Un'analisi approfondita delle cellule epiteliali nell'albero respiratorio ha rivelato che le cellule epiteliali nasali, in particolare le cellule caliciformi / secretorie e le cellule ciliate, mostrano la più alta espressione di ACE2 di tutte le cellule epiteliali analizzate. L'espressione distorta dei recettori virali / proteine associate all'ingresso verso le vie aeree superiori può essere correlata a una maggiore trasmissività. Infine, molti dei geni principali associati all'espressione epiteliale delle vie aeree ACE-2 sono geni antivirali immuno-associati innati, altamente arricchiti nelle cellule epiteliali nasali. Questa associazione con le vie immunitarie potrebbe avere implicazioni cliniche per il decorso dell'infezione e della patologia virale ed evidenzia il significato specifico degli epiteli nasali nell'infezione virale.
Nel loro insieme, riteniamo che tutte queste proprietà giustifichino la progettazione di uno studio clinico per valutare e verificare se un trattamento locale della mucosa nasale con Lf solubilizzato in una formulazione spray intra-nasale e l'assunzione orale di Lf, potrebbero contrastare l'infezione e l'infiammazione del coronavirus. Lf agisce sia come barriera naturale della mucosa sia respiratoria che intestinale o invertendo i disturbi del ferro legati alla colonizzazione virale o modulando la risposta immunitaria o down-regolando le citochine pro-infiammatorie rilasciate dall'infiammazione virale, senza alcun rischio di possibili eventi avversi . Inoltre, l'inclusione di Lf nelle strutture di conservazione, come i liposomi, riduce la denaturazione gastrica e intestinale mantenendo la sua integrità e quindi la sua funzionalità biologica. Lf potrebbe essere utilizzato in pazienti asintomatici o lievemente sintomatici per prevenire il peggioramento della SARS-CoV2. Il dosaggio ideale di Lf deve essere diversificato in base alla gravità dei sintomi. I pazienti COVID-19 asintomatici dovrebbero usare 300 mg, somministrati per via orale, raddoppiando il dosaggio (massimo 1gr) per i pazienti lievemente sintomatici. Suggeriamo di mantenere il trattamento almeno fino a quando il tampone COVID-19 diventa negativo.